- Cardiology
- Urology
- Oncology
- Infectius Diseases
- Dentristry
- Neurology
- Preventive Medicine
- News
- Endovascular
- Health
- Dermatology
Una terapia detiene el deterioro cognitivo asociado al alzhéimer en pacientes
Una nueva terapia que emplea un anticuerpo monoclonal -aducanumab- ha demostrado reducir los depósitos de beta amiloide, una proteína relacionada con esta patología, en el cerebro de pacientes con enfermedad de Alzheimer. El estudio, que merece la portada de la revista «Nature» de esta semana y que ha tenido una duración de 12 meses, presenta datos preclínicos y los resultados de una primera fase de un ensayo clínico em fase Ib. En conjunto, los datos presentados también en rueda de prensa apoyan que el anticuerpo puede convertirse en una terapia para la enfermedad de Alzheimer al reducir la cantidad de proteína beta amiloide en el cerebro y deterner el deterioro cognitivo característico de esta patología. A pesar de ello, los expertos piden cautela hasta que se demuestre en ensayos clínicos en fase III que el medicamento funciona realmente y que es seguro para todos los pacientes.
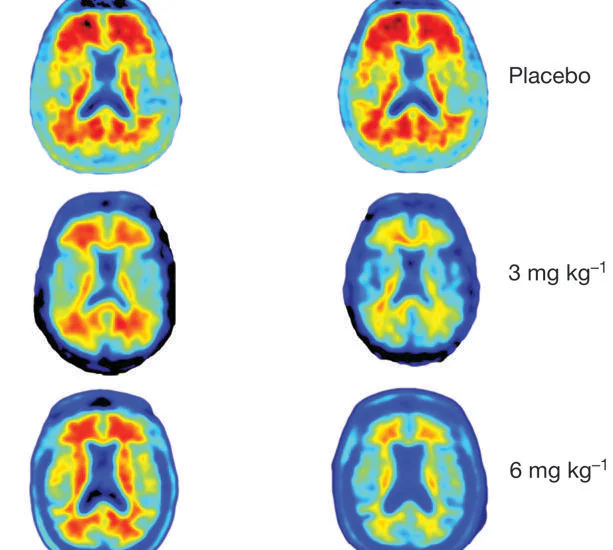
Se sabe que el acúmulo de la proteína beta amiloide en el cerebro es una característica de la enfermedad de Alzheimer y se piensa que la toxicidad relacionada con dicha proteína es una de las causas principales de la disfunción sináptica y de la neurodegeneración característica que subyace a la progresión del alzhéimer. Sin embargo, la mayoría de los intentos diseñados hacia la beta-amiloide beta habían fracasado. Hasta ahora.
El investigador de Biogen Alfred Sandrock y sus colegas explican que aducanumab es un anticuerpo monoclonal humano que se dirige selectivamente a la proteína beta amiloide. En un modelo de ratón transgénico, los investigadores han demostrado que aducanumab es capaz de atravesar la barrera hematoencefálica y así entrar en el cerebro y, en función de la dosis administrada de forma intravenosa, reducir la presencia de la beta amiloide soluble e insoluble. Además, un tratamiento de 54 semanas con el anticuerpo, como parte de un estudio de fase Ib, logró la reducción casi completa de las placas amiloides del cerebro en los 165 pacientes con enfermedad en estadio temprano de Alzheimer que participaron en el estudio.
Fuente:http://www.abc.es/salud/enfermedades/abci-terapia-detiene-deterioro-cognitivo-asociado-alzheimer-pacientes-201608311916_noticia.html
Hallan un fármaco contra el cáncer y la metástasis de colon y mama
Uno de los motivos principales por los que los pacientes oncológicos recaen en su enfermedad es por la presencia en el organismo de células madre cancerígenas (CMC) resistentes a los tratamientos con quimioterapia y radioterapia. Las CMC se encuentran en los tumores en muy bajo número y tienen como característica importante la formación de las metástasis en sitios diferentes al tumor original. Debido a que en condiciones normales se encuentran en estado durmiente (esto es, sin dividirse), la quimioterapia y la radioterapia no son capaces de destruir estas CMC. De hecho, tras una respuesta inicial al tratamiento, muchos pacientes con cáncer tienen recaídas debido a que las células madres tumorales no habían sido destruidas. En los últimos años, la investigación internacional se ha centrado en la búsqueda de nuevos fármacos que se dirijan selectivamente frente a estas células resistentes, de tal forma que si son eliminadas el tumor será destruido en su totalidad y ello dará lugar a la ansiada curación de los enfermos. Una carrera de décadas , ahora un equipo de investigadores del Instituto Biosanitario de Granada ha logrado dar un paso más en la larga carrera contra el cáncer y ha hallado un medicamento que ataca y destruye a esas células madre cancerígenas en tres tipos concretos de tumores: colon, mama y melanoma (piel).
El logro llega tras 20 años probando más de 2.000 compuestos. La unión hace la fuerza y el hito ha sido posible gracias a la convergencia de los científicos del grupo ‘Terapias avanzadas: diferenciación, regeneración y cáncer’, que dirige el catedrático de la Facultad de Medicina Juan Antonio Marchal. Junto a él, colaboran Joaquín Campos, de la Facultad de Farmacia, y María Ángel García, del hospital Virgen de las Nieves, así como las universidades de Jaén y Miami (Estados Unidos). Al fármaco lo han llamado Bozepinib y abre una puerta a la esperanza.Por lo pronto, el producto ha demostrado su actividad frente al cáncer y además es selectivo, ya que actúa únicamente sobre las células madre tumorales, por lo que se reduce la toxicidad habitual en este tipo de compuestos, que suelen atacar también –de manera indeseada por los médicos– a células sanas, provocando la caída del pelo o alteraciones gastrointestinales. Así lo defienden los investigadores, quienes han publicado sus avances en la revista ‘Oncotarget’. La limitación, de momento, es que la experiencia solo se ha probado con resultados positivos en ratones. A los animales se les había inducido previamente cáncer de mama, colon o melanoma y con la utilización de Bozepinib se bajó en ellos la formación de metástasis. Ahora, los investigadores quieren estudiar la actividad de este compuesto en un espectro más amplio de tumores. Y si tuvieran más financiación,se adentrarían en la realización de estudios más específicos de seguridad que les permitieran, finalmente, poner en marcha un ensayo clínico fase I, en pacientes. En cuanto a su futura utilización clínica, si ésta llegase, Marchal apuntó a que lo ideal sería una combinación de tratamientos. Así, en primer lugar se realizaría una cirugía para destruir al máximo la masa tumoral y después combinar este fármaco con quimioterapia a dosis más bajas.
Fuente:http://www.aldeaviral.com/hallan-un-farmaco-contra-el-cancer-y-la-metastasis-de-colon-y-mama-celebramos-la-noticia/
REALITY Trial Begins for Medtronic’s Directional Atherectomy and Drug-Coated Balloon in PAD Treatment
Medtronic plc and VIVA Physicians announced that the first patient was enrolled in the REALITY study. The study is assessing outcomes for patients with significantly calcified and symptomatic femoropopliteal peripheral artery disease (PAD) after adjunctive use of directional atherectomy and drug-coated balloon (DCB). The study is sponsored and managed by VIVA Physicians with support from Medtronic through an external research project grant.
According to Medtronic and VIVA Physicians, the REALITY study is evaluating patient outcomes with adjunctive use of the HawkOne or TurboHawk atherectomy systems and the In.Pact Admiral DCB.
The multicenter, international, prospective, single-arm study will enroll up to 250 subjects at up to 15 sites. The study includes angiographic and duplex ultrasound core lab adjudication. Primary patency is assessed by duplex ultrasound at 12 months. Patients are followed up to 24 months to determine clinically driven target lesion revascularization.
The study’s coprincipal investigators are Krishna Rocha-Singh, MD, and Brian DeRubertis, MD. Dr. Rocha-Singh is Chief Scientific Officer of Prairie Heart Institute of Illinois in Springfield, Illinois. Dr. DeRubertis is Associate Professor of Surgery at UCLA Division of Vascular Surgery in Los Angeles, California. The study will include investigative sites in the United States and Germany.
In the Medtronic and VIVA Physicians press release, Dr. Rocha-Singh commented, “PAD is a complex and progressive disease. The severity of the disease can often have an impact on treatment options for patients. Long lesion length and severe calcification are obstacles that challenge both our ability to gain acute luminal gain and to maintain long-term patency. REALITY is driven by the need to look at a viable treatment paradigm that combines the use of directional atherectomy and DCB therapy to address the challenges of treating complex PAD.”
Roger Gammon, MD, treated the first patient enrolled in the study. Dr. Gammon, who is an interventional cardiologist at Austin Heart Central-Heart Hospital in Austin, Texas, stated in the announcement, “We know that directional atherectomy and DCB perform well as standalone treatments, and early data suggest that combined therapy may improve patient outcomes in more complex lesions. Through REALITY, we hope to answer this critical question with rigorous clinical data in this well-designed study.”
Source:http://evtoday.com/2016/07/27/reality-trial-begins-for-medtronics-directional-atherectomy-and-drug-coated-balloon-in-pad-treatment?utm_source=iContact&utm_medium=email&utm_campaign=Endovascular%20Today%20Europe&utm_content=EVT+Europe+enews+7%2F29
Regulatory T cells' involvement in the progress of colon cancer
Researchers at Osaka University, clarified that T-lymphocytes expressing FOXP3 at a low level found in colorectal cancers (CRCs) facilitated cancer immunity. FOXP3 is a master gene of Regulatory T (Treg) cells that suppress various immune responses including cancer immuity. They found that a certain intestinal bacteria species was involved in the induction of such FOXP3-low T cells enhancing tumor immunity. These findings suggest new potentials in the treatment of CRCs via regulation of intestinal bacteria.
Treg cells have been drawing attention in cancer immunotherapy. Since Treg cells suppress the immune cells that attack tumors, they are thought to be disadvantageous for antitumor immunity. Indeed tumor-infiltrating Treg cells have been reported as a factor for poor prognosis in many cancers. However, results running counter to the notion have been found with CRCs, leaving the roles of Treg cells in CRCs unclear.
A research group led by Professor Shimon Sakaguchi at the Immunology Frontier Research Center*, Osaka University now discovered that among the FOXP3+ cells that had infiltrated deeply into CRCs, a group of T-cells with low FOXP3 expression were facilitating cancer immunity. Although the majority of FOXP3+ T-cells are thought to be immunosuppressive Treg cells, this research showed that a group of FOXP3-low (FOXP3lo) cells did not possess immune-suppressing functions but rather augment immune responses and that they were induced by inflammatory cytokines such as IL-12, which was induced by intestinal bacteria attaching to CRCs. CRCs with abundant infiltration of such inflammatory FOXP3lo Treg cells showed good prognosis, while those with predominant FOXP3hi Treg cell infiltration like other cancers showed poor prognosis.
Detailed analysis of the lymphocytes invading CRCs allowed the researchers to clarify the roles of Treg cells and FOXP3+ cells as well as the influence of intestinal bacteria in inducing these cells. Intestinal bacteria attaching to CRCs cause tumor-internal inflammation by invading the tumor, thereby inducing FOXP3lo Treg cells facilitating tumor immunity. In addition, the researchers found that FOXP3hi Treg cells, unlike FOXP3lo T-cells, suppressed antitumor immunity response as seen with other cancers.
In this research, the researchers were able to conduct an accurate assessment of FOXP3+ cells in CRCs. Precise identification of these cell groups will become a useful marker for assessing immune status in cancer tissues. Since cancer immunotherapy is effective for only some types of tumors, the research results suggest new potentials for cancer immunotherapy targeting Treg cells while also defining new patient groups. Furthermore, new preventive potentials for intestinal cancers can be expected by controlling intestinal bacteria as it was demonstrated that these bacteria can increase cancer immunity via inflammation in tumors.
Source: http://www.eurekalert.org/pub_releases/2016-07/ou-rtc070416.php
La EMA recomienda la retirada de genéricos basados en estudios de la india Semler Research
La Agencia Europea del Medicamento (EMA) ha emitido un comunicado en el que recomienda la suspensión de medicamentos genéricos cuyos estudios de bioequivalencia hayan estado realizados por Semler Research Center, ubicado en Bangalore (India). "Los estudios de bioequivalencia realizados en este centro son defectuosos y no se pueden usar para apoyar la aprobación medicamentos en la Unión Europea (UE)", asegura la institución.
La Agencia también ha recomendado que los medicamentos que actualmente están siendo evaluados para su autorización y que se basan solamente en estudios de bioequivalencia de este centro no deben autorizarse hasta que haya estudios alternativos.
En concreto y en lo referente a España, esta recomendación de la EMA afecta a 10 medicamentos correspondientes a cinco principios activos presentados ante el consumidor con distintas dosis y formatos. Todos ellos incluidos en una lista hecha pública por la EMA, y que afecta también al resto de países que conforman la UE. Compañías como Sandoz, Teva, Accord, Brill, Pensa o VIR son las afectadas en España al contar con fármacos genéricos cuyos estudios de bioequivalencia son de Semler Research Center. Principios activos como saquinavir, atovaquone/proguanil, erlotinib, eprosartan y celecfoxib son los afectados en España.
En este sentido, desde Laboratorios Accord han aclarado a EG que "Laboratorios Accord consta en la lista de la EMA con un único producto, Saquinavir, que actualmente estaba siendo evaluado para su autorización, por lo que no procede retirada del mercado de ningún de los principio activo actualmente comercializado".
La detección de estas irregularidades en la bioequivalencia viene provocada por una inspección de la agencia estadounidense (FDA) que destapó la sustitución y manipulación de muestras clínicas de los sujetos en los estudios realizados por Semler. LaOrganización Mundial de la Salud (OMS) también planteó serias preocupaciones con respecto a la integridad y la manipulación de las muestras de estudio siguiendo sus propias inspecciones de los datos de bioanálisis de Semler.
Los resultados de las inspecciones de la FDA y la OMS ponen en cuestión el sistema de gestión de calidad usado en Semler, y por lo tanto sobre la fiabilidad de todos los estudios de bioequivalencia, incluidos los utilizados para apoyar las solicitudes de autorización de comercialización en la UE.
El Comité de Medicamentos de Uso Humano (CHMP) de la EMA ha llegado a la conclusión de que los estudios realizados en Semler no pueden aceptarse las solicitudes de autorización de comercialización en la UE. Por lo tanto, no hay medicamentos pueden ser aprobadas sobre la base de estos estudios.
También se da la circunstancia de que durante la evaluación de estos medicamentos se presentaron estudios alternativos a los de Semler para algunos de los fármacos sobre los que recae la recomendación de suspensión de su autorización de comercialización. Estos estudios demostraron bioequivalencia y por lo tanto, el CHMP ha recomendado que puedan permanecer en el mercado. En este caso estarían afectadas tres compañías —Lupin, Sandoz y Mylan — y un sólo principio activo —abacavir/lamivudine — .Incluidos en otra lista de medicamentos recomendados para permanecer en el mercado.
Por otro lado, algunos de los medicamentos que han sido recomendados para la suspensión pueden ser de importancia crítica por la falta de alternativas disponibles. Por lo tanto, las autoridades nacionales pueden posponer temporalmente la suspensión en el interés de los pacientes. Los estados miembros deben decidir si se necesitan retirada del mercado de los medicamentos afectados en sus territorios. La recomendación del CHMP sobre estos medicamentos se enviará ahora a la Comisión Europea para una decisión legalmente vinculante válida en toda la Unión Europea.
Fuente:http://www.elglobal.net/noticias-medicamento/2016-07-27/industria-farmaceutica/la-ema-recomienda-la-retirada-de-genericos-basados-en-estudios-de-la-india-semler-research/pagina.aspx?idart=994443